再鼎医药公布2021年第三季度财务业绩和公司进展
- 丰富的产品管线持续拓宽拓深,新增3款潜在同类首创或同类最优药物
- 公司将于美国东部时间2021年11月10日上午8点召开电话和网络会议
中国上海,美国旧金山和马萨诸塞州剑桥,2021年11月9日 — 再鼎医药有限公司(纳斯达克股票代码:ZLAB;香港联交所股票代码:9688),一家以患者为中心的、处于商业化阶段的创新型全球生物制药公司,今天公布了2021年第三季度的财务业绩,以及近期产品亮点和公司进展。
再鼎医药创始人、董事长兼首席执行官杜莹博士表示:“在2021年第三季度,再鼎医药继续取得强劲的增长和业绩表现。我们丰富且创新的产品管线取得重大进展,近期又新增三款潜在突破性药物。我们与 Blueprint Medicines 就两种有前景的肺癌疗法达成合作协议,有望进一步加强我们潜在的世界一流的肺癌管线。我们与 Karuna Therapeutics 达成合作,使我们将产品管线拓展到中枢神经系统领域。中枢神经系统领域患者数量庞大,存在巨大的未满足医疗需求。”
我们第三季度的业绩亮点包括:
- 我们的三款已上市产品则乐、爱普盾及擎乐,在强劲的市场需求和我们强大的商业化执行力推动下,取得稳健的业绩增长。
- 则乐用于一线卵巢癌的适应证在中国香港地区获批并上市。
- QINLOCK(中国内地注册商品名:擎乐,中国台湾地区注册商品名:期乐)用于治疗四线胃肠间质瘤的适应证在中国台湾地区获批并上市。
- 公布了 adagrasib 针对结直肠癌的 1/2 期研究阳性结果和针对非小细胞肺癌的2 期潜在注册研究的主要结果。
- 公布了在具有相关基因组异常的晚期癌症患者中开展的repotrectinib 2 期研究和elzovantinib (TPX-0022) 1 期研究令人鼓舞的最新数据。
- 完成肿瘤电场治疗用于胃癌的临床研究的患者入组;预计在 2022 年上半年公布2期初步研究的主要数据解读。
- 正在准备肿瘤电场治疗用于恶性胸膜间皮瘤和马吉妥昔单抗用于 HER2 阳性乳腺癌的上市申请文件。
- 与国家药品监督管理局 (NMPA) 沟通会表明,有可能加速审批efgartigimod在国内用于重症肌无力 (gMG) 的上市申请。视美国FDA的审批及与国家药品监督管理局的进一步讨论而定,我们期待于2022年上半年在中国提交新药上市申请。我们的合作伙伴 argenx 预计美国 FDA 将于第四季度就efgartigimod 用于治疗gMG 的上市申请做出决定。
- 再鼎医药内部开发的用于斑块状银屑病的抗 IL-17A Humabody®抗体ZL-1102已完成概念验证,现将进入全球临床开发阶段。
- 公布了舒巴坦- durlobactam (SUL-DUR) 治疗不动杆菌感染的全球 3 期 ATTACK 研究的阳性主要结果。
杜莹博士表示:“今年对于再鼎来说是硕果累累的一年,我们建立起兼具深度和广度的更加强大的创新产品管线,已经涵盖28款产品。我们期待在第4季度及2022年达成更多里程碑,创造更多价值。”
近期产品亮点及预期里程碑
肿瘤领域
则乐®(尼拉帕利)
则乐是一种口服、每日一次的小分子聚ADP-核糖(PARP) 1/2抑制剂,是唯一在美国、欧盟地区和中国内地(以下简称“中国”)获批的无论患者生物标记物状态如何,均可单药用于晚期卵巢癌治疗的PARP抑制剂。
近期产品亮点
- 2021年8月,再鼎医药宣布,香港卫生署已批准则乐的新适应证,作为单药用于对一线含铂化疗完全或部分缓解的晚期浆液性上皮卵巢癌成人患者的维持治疗。与其他在香港获批用于卵巢癌一线维持治疗的PARP抑制剂不同的是,则乐在给药之前无需进行BRCA突变或其它生物标记物检测。
再鼎医药2021年预期里程碑事件
- 公布则乐用于中国卵巢癌患者一线维持治疗的3期临床研究PRIME的主要结果。
- 争取则乐卵巢癌一线适应证纳入国家医保药品目录(NRDL)。
- 继续探索其它适应证及与其它药物联用的机会。
肿瘤电场治疗
肿瘤电场治疗是一种利用特定电场频率干扰细胞分裂,抑制肿瘤生长并可能导致癌细胞死亡的癌症疗法。
近期产品亮点
- 2021年10月,再鼎医药合作伙伴Novocure宣布,已完成用于复发卵巢癌治疗的3期关键研究INNOVATE-3的最后一例患者入组。
- 2021年10月,再鼎医药与合作伙伴Novocure宣布,已完成肿瘤电场治疗联合化疗作为胃腺癌患者一线治疗的2期研究最后一例患者入组。预计将于2022年上半年收集最终数据。
- 2021年9月,再鼎医药合作伙伴Novocure宣布,将与罗氏合作开展临床研究,探索肿瘤电场治疗联合罗氏抗PD-L1疗法阿替利珠单抗用于转移性胰腺癌一线治疗。
- 2021年9月,再鼎医药合作伙伴Novocure宣布,美国FDA已授予NovoTTF-200T系统(一种肿瘤电场治疗系统)突破性疗法认定,联合阿替利珠单抗及贝伐珠单抗用于不可切除的或转移性肝癌患者的一线治疗。该认定的授予,使Novocure有机会与FDA的专家就多个方案进行沟通,更高效地解决上市前审评阶段相关审批问题,并将优先审评递交的文件。
- 自2020年第3季度在中国商业上市以来,爱普盾已被列入25个省级或市级政府指导的区域定制商业健康保险计划(或补充保险计划)。
再鼎医药2021年及2022年初的预期里程碑事件
- 提交用于治疗恶性胸膜间皮瘤的上市许可申请 (MAA)。
- 加入肿瘤电场治疗用于局部晚期胰腺癌的全球3期关键研究PANOVA-3。
合作伙伴2021年预期里程碑事件
- 完成肿瘤电场治疗用于非小细胞肺癌的3期关键研究LUNAR的患者入组。
擎乐®(瑞派替尼)
擎乐是一款开关控制酪氨酸激酶抑制剂,经设计以广泛抑制突变的KIT及PDGFRα激酶,是唯一在美国和中国获批用于治疗所有曾接受过三种或以上酪氨酸激酶抑制剂治疗的晚期胃肠间质瘤 (GIST) 患者的疗法。
近期产品亮点
- 2021 年 11 月,再鼎医药合作伙伴 Deciphera 公布了擎乐用于此前接受过伊马替尼治疗的 GIST 患者的 INTRIGUE 3 期临床研究的主要结果。与标准治疗方案舒尼替尼相比,该研究未达到改善无进展生存期的主要终点。再鼎医药预估INTRIGUE研究结果将不会对公司的当前运营产生实质影响。
- 2021 年9月,再鼎医药宣布,台湾地区药物审批部门批准QINLOCK(中国内地注册商品名:擎乐,中国台湾地区注册商品名:期乐)的新药上市申请(NDA),用于治疗曾接受过包括伊马替尼在内的三种或以上激酶抑制剂治疗的晚期胃肠间质瘤成人患者。
- 自2021年5月在中国商业上市以来,擎乐已被列入28个补充保险计划。
合作伙伴2021年预期里程碑事件
- 擎乐有望获得欧洲药品管理局的上市批准。
- 启动与MEK抑制剂binimetinib联用的1b/2期研究,针对伊马替尼难治或不耐受的胃肠间质瘤患者。
Adagrasib
Adagrasib是一款高选择性的强效口服小分子KRASG12C抑制剂,用于治疗KRASG12C突变的非小细胞肺癌、结直肠癌 (CRC) 、胰腺癌和其它实体瘤。
近期产品亮点
- 2021 年 11 月,Mirati 宣布,KRYSTAL-1 研究1b 期队列在 8 名 KRASG12C 突变的一线非小细胞肺癌患者中评估adagrasib 联合帕博利珠单抗疗法的初步结果支持,继续开发每日两次使用adagrasib 400毫克(400 mg BID)联合全剂量的帕博利珠单抗,该联合疗法将在正在进行的2 期 KRYSTAL-7 研究中进行评估。
- 2021年9月,再鼎医药合作伙伴Mirati宣布潜在注册性2期研究KRYSTAL-1的阳性主要结果,该研究旨在评估adagrasib用于治疗曾接受系统治疗的具有KRASG12C突变的晚期非小细胞肺癌患者的疗效。基于截至2021年6月15日的中心独立审查,每日两次使用adagrasib 600毫克(600 mg BID),显示客观缓解率 (ORR) 为43%,疾病控制率为80%。中位随访期为9个月。安全性和耐受性与此前报告的adagrasib用于晚期非小细胞肺癌的研究结果一致。
- 2021 年 9 月,再鼎医药合作伙伴Mirati宣布1/2期研究KRYSTAL-1部分队列的结果,该研究旨在评估每日两次使用adagrasib 600毫克(600 mg BID),作为单药疗法及与西妥昔单抗联用治疗既往接受过多线治疗的KRASG12C突变的结直肠癌患者。结果显示,adagrasib单药及与西妥昔单抗联用在这些患者中均显示显著的临床活性和广泛的疾病控制。
合作伙伴2021年预期里程碑事件
- Mirati已宣布,计划将于 2021 年底之前在美国提交adagrasib 单药治疗曾接受系统治疗的晚期非小细胞肺癌患者的新药上市申请。
Odronextamab
Odronextamab是一款双特异性抗体,旨在通过连接并活化细胞毒性T细胞(与CD3结合)及淋巴瘤细胞(与CD20结合),触发抗肿瘤作用。
近期产品亮点
- 2021年10月,再鼎医药宣布完成全球2期潜在关键研究大中华区的首例患者给药。
合作伙伴2021及2022年预期里程碑事件
- 预计将于2021年第4季度启动皮下注射剂型的研究。
- 于2022年启动更大范围的 3期研究项目。
Repotrectinib
Repotrectinib是新一代酪氨酸激酶抑制剂 (TKI) ,能有效靶向作用于ROS1及TRK A/B/C ,对既往未接受过TKI治疗或TKI经治的患者均有治疗潜力。
近期产品亮点
- 2021年10月,再鼎医药合作伙伴Turning Point公布了正在进行的1/2期TRIDENT-1研究中,其重要候选药物repotrectinib用于既往未接受TKI治疗及TKI经治的NTRK阳性晚期实体瘤队列(EXP-5和EXP-6)的早期临床数据。
- TKI经治的NTRK阳性晚期实体瘤患者中经确认的客观缓解率为48%。
- TKI经治的存在溶剂前沿突变的NTRK阳性晚期实体瘤患者中经确认的客观缓解率为62%。
- 既往未接受过TKI治疗的NTRK阳性晚期实体瘤患者中经确认的客观缓解率为41%。
- 2021年10月,再鼎医药合作伙伴Turning Point公布正在进行的TRIDENT-1研究的最新临床数据。TRIDENT-1研究表明,Repotrectinib在多个ROS1阳性TKI经治非小细胞肺癌的队列中显示出临床活性,经确认的客观缓解率为30–39%。在具有G2032R溶剂前沿突变的ROS1阳性TKI经治非小细胞肺癌患者中,repotrectinib经确认的客观缓解率为53%。
- 2021年10 月,再鼎医药合作伙伴Turning Point 公布正在进行的1/2 期CARE研究的早期临床数据,该研究针对具有ALK、ROS1或NTRK异常的晚期实体瘤儿童和年轻患者。
- 2021年10月,再鼎医药合作伙伴Turning Point宣布,FDA已授予repotrectinib第2个突破性疗法认定,用于治疗NTRK基因融合的晚期实体瘤患者,这些患者前线接受包括一个或两个TRK酪氨酸激酶抑制、接受或没有接受过化疗后出现疾病进展,并且没有令人满意的替代疗法。
- 2021年8 月,再鼎医药合作伙伴Turning Point 宣布启动1b/2 期TRIDENT-2 研究的第一队列,该队列为探索repotrectinib联合MEK 抑制剂曲美替尼用于治KRASG12D突变的晚期实体瘤患者。
合作伙伴2021及2022年预期里程碑事件
- 预计将于 2021 年第4季度与 FDA 在 B 类会议上讨论repotrectinib用于NTRK 阳性 TKI 经治晚期实体瘤患者上市申请的下一步计划。
- 预计将报告TRIDENT-1 研究所有 ROS1 阳性非小细胞肺癌队列的盲态独立中心审查 (BICR) 主要数据,并在 2022 年第2季度的 NDA 递交前会议上与 FDA 讨论该 BICR 数据。
麦甘乐® (马吉妥昔单抗)
麦甘乐是一款靶向作用于人表皮生长因子受体2 (HER2) 的Fc段优化的单克隆抗体。
近期产品亮点
- 2021年10月,再鼎医药宣布,马吉妥昔单抗联合化疗用于曾接受过治疗的晚期HER2阳性乳腺癌患者的桥接研究达到了主要终点,安全性及耐受性均可接受。研究表明,该组合疗法在中国患者中的疗效与再鼎医药合作伙伴MacroGenics开展的SOPHIA研究中对全球人群的疗效一致。
再鼎医药2021年/2022年初预期里程碑事件
- 于今年年底前后递交经治HER2阳性转移性乳腺癌的新药上市申请。
Bemarituzumab
Bemarituzumab是一款同类首创抗体,作为针对FGFR2b过度表达的肿瘤靶向疗法,正在进行针对胃癌及胃食管交界部癌的开发。
近期产品亮点
- 2021 年 11 月,再鼎医药合作伙伴安进宣布,已启动 bemarituzumab 用于一线晚期胃癌和胃食管交界部腺癌的注册性 3 期研究计划。该研究将探索 bemarituzumab 与化疗或与化疗加检查点抑制剂联合的疗法。
- 2021年9月,再鼎医药宣布,国家药品监督管理局药品审评中心 (CDE) 授予了bemarituzumab突破性疗法认定,与经改良FOLFOX6(氟嘧啶、亚叶酸钙和奥沙利铂)联用,用于一线治疗FGFR2b 过度表达和HER2阴性的转移性和局部晚期胃和胃食管交界部 (GEJ) 癌。
合作伙伴2022年初预期里程碑事件
- 预计将于 2022 年第1季度启动一项评估bemarituzumab 单药及联合化疗治疗晚期难治性鳞状非小细胞肺癌的 1b 期探索研究。其它实体瘤的探索研究正在计划中。
Elzovantinib (TPX-0022)
Elzovantinib (TPX-0022)是一款口服多靶点激酶抑制剂,具有新型三维大环结构,可抑制MET、CSF1R(集落刺激因子1受体)及SRC激酶。
近期产品亮点
- 2021年10月,再鼎医药合作伙伴Turning Point公布了I期SHIELD-1 研究剂量探索部分的最新临床数据。该研究显示, elzovantinib在具有MET基因异常的MET TKI初治非小细胞肺癌和胃及胃食管交界部癌患者中经确认的的客观缓解率分别为36%和33%。
合作伙伴2021及2022年预期里程碑事件
- 根据 FDA 的建议,需要在至少 6 到 10 名患者中探索一个额外的中间剂量,目的是将 SHIELD-1 研究修订为潜在的注册性 1/2 期研究。视 FDA 2022年的反馈,Turning Point 计划启动 SHIELD-1 研究的2期部分。
- 预计于 2021 年第4季度获得FDA关于 elzovantinib 用于胃及胃食管交界部癌开发路径的反馈。
- 预计于2022年年中启动与表皮生长因子受体 (EGFR) 靶向疗法联用的1b/2期SHIELD-2研究 (视新药临床研究申请(IND)获得FDA批准的时间而定)。
Tebotelimab
Tebotelimab是一款靶向作用于PD-1及LAG-3的处于研究阶段的、同类首创、双特异性四价DART分子。
近期产品亮点
- 再鼎医药在大中华区拓展tebotelimab与则乐联用的1b/2期研究的新的适应证,包括胃癌、三阴性乳腺癌和胆管癌。2021 年10月,再鼎医药完成了子宫内膜癌队列的首个患者入组。
再鼎医药和合作伙伴2022年上半年预期里程碑事件
- 提供正在进行的临床研究的最新数据,以及下一阶段的开发计划。
BLU-945
BLU-945是一款选择性的强效EGFR激活突变抑制剂,包括获得性T790M和C797S突变,后者是常见的靶向耐药机制。BLU-945有望用于治疗EGFR阳性非小细胞肺癌。
近期产品亮点
- BLU-945 用于治疗耐药、EGFR 驱动的非小细胞肺癌的全球 1/2 期研究已于 2021 年第2季度启动。
合作伙伴2022年上半年预期里程碑事件
- 将在医学会议上公布支持 BLU-945 和 BLU-701 联合治疗 EGFR 驱动的非小细胞肺癌的临床前数据。
BLU-701
BLU-701是一款选择性的强效EGFR激活突变抑制剂,包括获得性C797S突变,后者是常见的靶向耐药机制。BLU-701 有望用于治疗EGFR阳性非小细胞肺癌。
合作伙伴2021年预期里程碑事件
- 将于2021年第4季度启动BLU-701用于EGFR 驱动的非小细胞肺癌的1期研究。
ZL-1201 (CD47 抑制剂,全球权益)
ZL-1201是一款人源化IgG4单克隆抗体,经改造可降低效应功能,特异性靶向CD47。其治疗潜力将在实体瘤和血液系统恶性肿瘤中进行评估,包括单药疗法和联合疗法。
再鼎医药2021年及2022年初预期里程碑事件
- 通过正在进行的I期临床研究,确定2期临床研究的推荐剂量。
Simurosertib, ZL-2309 (CDC7抑制剂,全球权益)
Simurosertib或ZL-2309是一款可能成为同类首创的口服、选择性CDC7抑制剂,CDC7是一种蛋白激酶,在DNA复制和绕过DNA损伤反应中起关键作用。
再鼎医药2021年及2022年初预期里程碑事件
- 启动生物标记物驱动的2期概念验证性研究。
自身免疫疾病领域
Efgartigimod
Efgartigimod是一种抗体片段,旨在减少致病性免疫球蛋白G (IgG) 抗体及阻断IgG的循环利用过程。Efgartigimod可与新生儿Fc受体 (FcRn) 结合,FcRn在全身内广泛表达并在阻止IgG 抗体的降解方面发挥核心作用。
再鼎医药2021年预期里程碑事件
- 在使用皮下制剂治疗原发免疫性血小板减少症 (ITP) 、慢性炎性脱髓鞘性多发性神经根神经病(CIDP)和天疱疮的全球3期关键研究中入组大中华区首批患者。
- 继续与我们的合作伙伴argenx合作,探索及推进其它适应症证的临床开发。
合作伙伴2021及2022年初预期里程碑事件
- Efgartigimod用于治疗gMG患者的上市申请有望获得FDA批准并于全球上市(PDUFA的药证审批时程为2021年12月17日)。
- 于2021年底启动大疱性类天疱疮的临床研究,于2022年第1季度启动肌炎的临床研究。
ZL-1102 (IL-17全人源VH抗体片段,全球权益)
ZL-1102是一款新型全人源VH抗体片段 (Humabody®),靶向作用于IL-17A细胞因子,具有高亲和力和活性。有别于其它抗IL-17产品,正在开发的ZL-1102将用于慢性斑块状银屑病(CPP)的局部治疗。
近期产品亮点
- 2021 年 10 月,再鼎医药宣布 ZL-1102 用于银屑病的1b 期研究达成概念验证。使用ZL-1102局部治疗轻中度慢性斑块状银屑病患者可改善局部PASI评分、红斑和鳞屑、皮损面积和应答率,并显示出持续的临床改善。
再鼎医药2022年预期里程碑事件
- 推进ZL-1102在全球范围内的全面开发。
抗感染领域
纽再乐®(甲苯磺酸奥马环素)
纽再乐是一款每日一次口服或静脉使用的抗生素,用于治疗社区获得性细菌性肺炎(CABP)及急性细菌性皮肤和皮肤结构感染(ABSSSI)的成人患者。
再鼎医药2021年预期里程碑事件
- 纽再乐用于治疗CABP及ABSSSI的上市申请有望获得国家药品监督管理局批准并上市。
舒巴坦-Durlobactam (SUL-DUR)
舒巴坦-Durlobactam是一种β-内酰胺╱β-内酰胺酶抑制剂的组合型新药,对于包括碳青霉烯耐药菌株在内的鲍曼不动杆菌具有独特活性。
近期产品亮点
- 2021年10月,再鼎医药与合作伙伴Entasis公布不动杆菌感染全球注册性3期临床研究ATTACK的阳性主要数据解读。计划将于2022年年中向FDA提交新药上市申请。
- SUL-DUR率先在耐碳青霉烯不动杆菌 (CRAB) 患者中实现28天全因死亡率的统计非劣效性。
- 与多黏菌素相比,在临床治愈评估上存在显著的统计学差异。
- 良好的安全性,具有统计学意义的肾毒性显著降低。
中枢神经系统
KarXT
KarXT 将新型毒蕈碱激动剂呫诺美林与已获批的毒蕈碱拮抗剂曲司氯铵结合,优先激活中枢神经系统中的毒蕈碱受体,有望用于治疗精神分裂症和痴呆相关的精神病性障碍。
近期产品亮点
- 启动了用于治疗精神分裂症的所有EMERGENT 3 期研究的患者入组。
- 在《新英格兰医学杂志》上发表了 EMERGENT-1 研究数据。
合作伙伴2021年预期里程碑事件
- 启动3 期 ARISE 研究,评估KarXT用于对当前标准疗法反应不佳的精神分裂症成年患者。
- 推动KarXT的新剂型进入临床开发阶段。
公司最新动态
- 2021年10月,再鼎医药宣布任命Scott Morrison为其董事会成员。
- 2021年9月,再鼎医药举办了线上研发日活动,帮助分析师和投资人深入了解公司产品管线和全球运营。
- 2021年9月,再鼎医药宣布在美国马萨诸塞州剑桥生物技术圈正式设立新的办公室,进一步拓展在美国的运营。全新的剑桥办公室将涵盖多个职能的业务运营,包括商业联盟管理、业务拓展、法务和公司治理职能等。
- 再鼎医药团队持续壮大。第三季度新加入的员工包括全球后期开发负责人、高级副总裁Mehrdad Mobasher博士,副首席财务官、高级副总裁陈娅静博士,以及首席可持续发展官Jim Massey。
- 截至2021年9月30日,再鼎医药共有1,864名全职员工,其中从事研发和商业化岗位的员工分别为713名和944名。
2021年第三季度财务业绩
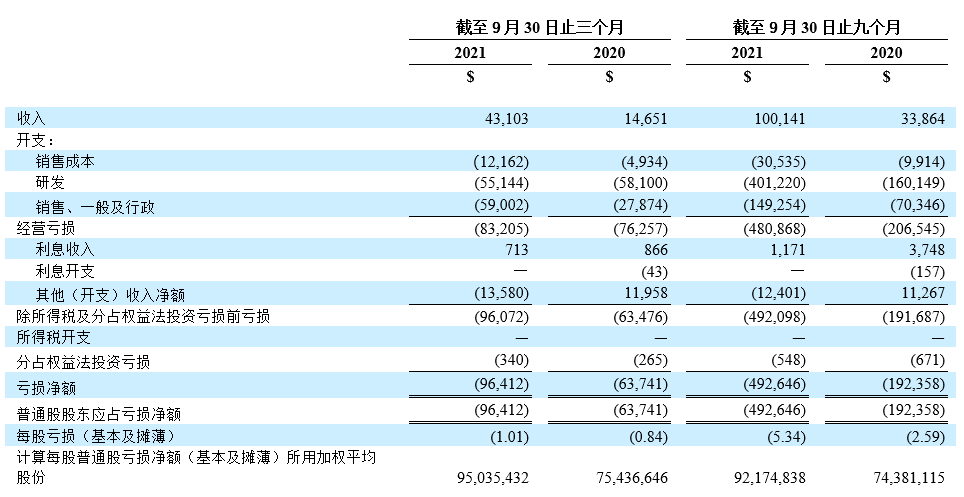
- 截至2021年9月30日止三个月,产品净收入为4,310万美元,2020年同期收入为1,470万美元。其中包括则乐销售收入2,810万美元(2020年同期为850万美元)、 爱普盾销售收入1,070万美元(2020年同期为600万美元)和擎乐销售收入430万美元(2020年同期为20万美元)。
- 截至2021年9月30日止三个月的研究与开发(研发)支出为5,510万美元,2020年同期为5,810万美元。研发开支的降低主要由于新的授权引进协议预付款降低,部分被正在进行及新启动的后期临床研究的相关费用、增聘研发人员的工资及工资相关开支抵销。
- 截至2021年9月30日止三个月的销售、一般及行政开支为5,900万美元,2020年同期为2,790万美元。增加主要由于扩大的商业化团队的工资及工资相关开支以及再鼎医药持续在中国扩展商业经营的相关开支所致。
- 截至2021年9月30日止三个月,再鼎医药亏损净额为9640万美元(或普通股东应占每股亏损为1.01美元),2020年同期的亏损净额为6,370万美元(或普通股东应占每股亏损为0.84美元)。亏损净额的增加主要由于扩展商业运营的相关开支所致。
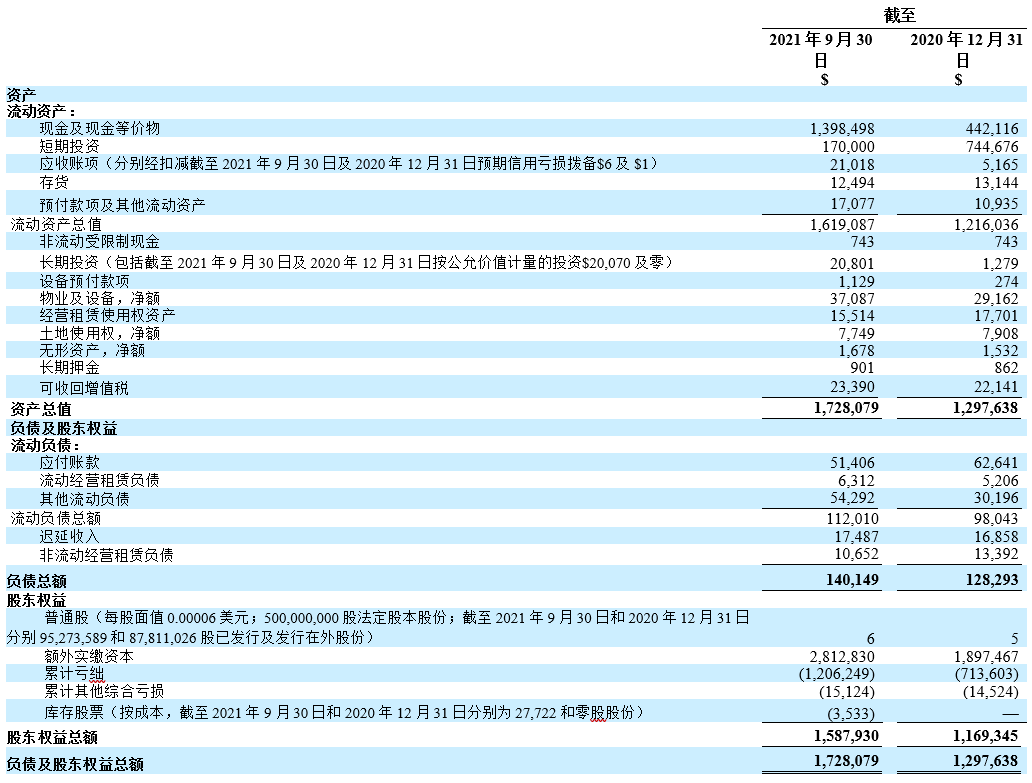
- 截至2021年9月30日,现金及现金等价物、短期投资及受限制现金合计为15. 692亿美元,而截至2020年12月31日则为11.875亿美元。
电话会议和网络直播相关信息
再鼎医药将于美国东部时间2021年11月10日上午8点举办电话会议和网络直播。与会者可以访问公司网站http://ir.zailaboratory.com参与实时网络直播。如要参加电话会议,需提前注册。详细信息如下:
- 注册链接: http://apac.directeventreg.com/registration/event/9666772
- 会议ID: 9666772
所有参会者都必须在电话会议之前通过上述链接完成在线注册。注册成功后,您将收到拨入号码、活动密码和接入识别码,用于参加电话会议。
关于再鼎医药
再鼎医药(纳斯达克股票代码:ZLAB;香港联交所股票代码:9688)是一家以患者为中心的、处于商业化阶段的创新型全球生物制药公司,致力于通过创新疗法的开发和商业化解决肿瘤、自身免疫、感染性疾病和中枢神经系统领域未被满足的医疗需求。为达到这一目标,公司经验丰富的团队已与全球领先的生物制药公司建立了战略合作,打造起由创新的已上市和候选产品组成的丰富的产品管线。再鼎医药已建立起具有强大药物研发和转化研究能力的内部团队,正在打造拥有国际知识产权的候选药物管线。我们的愿景是成为一家领先的全球生物制药公司,研发、生产并销售创新产品,为促进全世界人类的健康福祉而努力。
有关公司的更多信息,请访问www.zailaboratory.com或关注公司领英账号:https://www.linkedin.com/company/zai-lab/ 及微信公众号:再鼎医药。
再鼎医药有限公司
未经审核简明合并资产负债表
(千美元(“$”),股份数目及每股数据除外)
再鼎医药有限公司
未经审核简明合并经营表
(千美元(“$”),股份数目及每股数据除外)
再鼎医药有限公司
未经审核简明合并综合亏损表
(千美元 ("$") ,股份数目及每股数据除外)
